پیل سوختی یک مبدل انرژی شیمیایی به انرژی الکتریکی است. این تبدیل مستقیم بوده و از بازده بالایی برخوردار خواهد بود. معروفترین نوع پیل های سوختی حال حاضر پیل سوختی هیدروژنی است. در مورد پیل سوختی هیدروژنی میتوان گفت که در این تبدیل از عمل عکس الکترولیز آب استفاده میگردد، به عبارت دیگر از واکنش بین هیدروژن و اکسیژن، آب، حرارت و الکتریسیته تولید میگردد. هر سلول در پیلهای سوختی از اجزاء آنُد، کاتُد و الکترولیت و غشاء تشکیل شده است.
اجزای پیل های سوختی:
• یک الکترولیت
• دو الکترود آند و کاتد
که در آن کاتد قطب مثبت و آند منفی میباشد.
- آند: الکترودی که در آن اکسیداسیون رخ می دهد. (از دست دادن الکترون)
- کاتد: الکترودی که در آن کاهش (احیاء) رخ می دهد. (مصرف یا دریافت الکترون)
سیستم های پیل سوختی
طراحی سیستم های مربوط به پیل پیچیده و با توجه به نوع پل و کاربرد آن متفاوت است. با این حال، بیشتر این سیستم ها از چهار مولفه اصلی تشکیل شده اند:
- پردازشگر سوخت
- ابزار تبدیل انرژی (پیل سوختی)
- مبدل جریان
- سیستم بازیافت حرارت (معمولا در سیستم های پیل سوختی دما بالا، برای کاربردهای ما استفاده می شود)
بیشتر سیستم های پیل سوختی زیر سیستم های دیگری برای کنترل رطوبت، دما، فشار گاز و آب تلف شده دارند که قسمت های اصلی آنها عبارت اند از:
1. پردازش گر سوخت
اولین جزء سیستم پردازش گر سوخت است. این قسمت سوخت را به شکل قابل استفاده برای پیل تبدیل می کند.
اگر سیستم با هیدروژن تغذیه شود، پردازشگر تنها برای صاف کردن ناخالصی های گاز هیدروژن به کار می رود. اگر سیستم با سوخت معمولی تغذیه شود، معمولا از یک اصلاح کننده برای تبدیل هیدروکربن ها به مخلوط گازی هیدروژن و ترکیب های کربنی به نام رفرمیت و استفاده می شود. بیشتر موانع، رفرمیت به یک رآکتور دیگر فرستاده می شود تا قبل از رفتن به پیل ناخالصی های آن (اکسیدهای کرین و سولفور) گرفته شوند. این کار از ترکیب ناخالصی های گاز با کاتالیزورها جلوگیری می کند. این فرآیند ترکیب، که راندمان و عمر مطلوب پیل را کاهش می دهد، مسموم کردن نام دارد.
بعضی از پیل های سوختی مانند پیل های کربنات و اکسید جامد در دماهای به اندازه کافی بالا کار می کنند، به طوری که سوخت در داخل پیل اصلاح می شود. پیل های با اصلاح داخلی به تله هایی برای به دام انداختن ناخالصی های سوخت اصلاح نشده، قبل از رسیدن به پیل، نیاز دارند. هر دو نوع اصلاح کننده سوخت، داخلی و خارجی، مقداری دی اکسید کربن تولید میکنند که کمتر از مقدار منتشره از موتور های احتراق داخلی در خودروهای بنزینی است.
2. ابزار تبدیل انرژی، پیل سوختی
پیل سوختی یعنی کل مجموعه ابزار تبدیل انرژی است. این وسیله از واکنش های شیمیایی پیل جریان مستقیم (DC) الکتریسیته تولید میکند.
3. مبدل و متغیر جربان
هدف استفاده از مبدل ها و متغیرهای جریان، هماهنگ کردن جریان الکتریکی تولیدشده از پیل با نیازهای الکتریکی ابزار کاربردی است که می تواند یک موتور الکتریکی ساده با پی شبکه توان پیچیده باشد.
پیل های سوختی الکتریسیته جریان مستقیم (DC) تولید می کنند. الکتریسیته مصرفی در منزل یا محل کار جریان متناوب (AC) است. بنابراین اگر برای راه اندازی ابزاری با جریان AC استفاده شود، باید جریان مستقیم به جریان متناوب تبدیل شود.
هر در توان AC و DC باید متغیر باشند. تغییر توان شامل کنترل جریان ( آمپر، ولتاژ، فرکانس) و دیگر مشخصه های جریان الکتریکی برای مطابقت با نیازهای کاربردی است. این تبدیل و تغییر راندمان سیستم را حدود ۲ تا ۹% کاهش میدهد.
4. سیستم بازیافت حرارت
سیستم های پیلهای سوختی اساسا برای تولید حرارت به کار نمی روند. با توجه به اینکه بعضی سیستم های پیل مقدار زیادی حرارت تولید می کنند خصوصا آنهایی که در دماهای بالا کار می کنند مانند سیستم های کربنات مذاب و اکسید جامد) می توان از این انرژی اضافه برای تولید بخار با آب گرم استفاده و یا آن را به کمک تورین گازی به الکتریینه تبدیل کرد. این کار راندمان انرژی کلی سیستم ها را افزایش می دهد.
پیل های سوختی بیشتر بر اساس جنس الکترولیت تقسیم بندی میشوند. و از انواع پیل سوختی میتوان به :
- پیل اسید فسفریک
- پیل قلیایی
- پیل پلیمری
- پیل مستقیم متانول
- پیل اکسید جامد
- پیل کربنات مذاب
- پیل بازیاب
اشاره کرد. که ما در ادامه، بصورت مختصر به برسی پیل های سوختی اسیدی و قلیلیی خواهیم پرداخت.
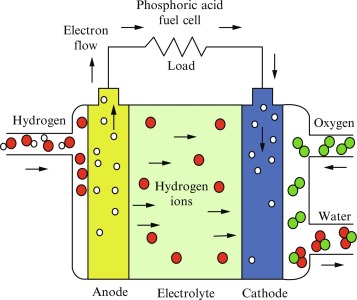
پیل سوختی اسید فسفریک:
در پیلهای سوختی اسید فسفریک، از اسید فسفریک مایع به عنوان الکترولیت استفاده میشود. این اسید در یک ماتریس سیلیکانی با باند تفلونی قرار دارد و دارای الکترودهای کربنی متخلخل شامل کاتالیزور پلاتینی است. پیل های سوختی اسید فسفریک (PAFC) نسل اول پیل های سوخت مدرن و از کامل ترین انواع پیل ها هستند. این نوع پیل برای تولید نیروی سیستم های ساکن به کار می رود، اما، بعضی از آنها برای راه اندازی وسایل نقلیه بزرگ مثل اتوبوس ها نیز استفاده شده اند.
برخی نکات و ویژگی ها:
- کاربرد برای سیستم های ساکن یا وسیله نقلیه بزرگ
- مقاومت کم در مقایسه با دیگر پیل های سوختی در برابر ناخالصی های اصلاح کننده
- قابلیت Poisoning یا مسموم شدن زود با CO یا مونوکسید کرین
- مسمومیت باعث کاهش راندمان پیل میشود
- وقتی از پیل برای تولید همزمان حرارت و الکتریسیته استفاده شود راندمانی در حدود 85% خواهد داشت
- تنها برای تولید الکتریسیته راندمان برابر 37 تا 42% خواهد بود
- و کمی بیشتر از راندمان نیروگاههای حرارتی با راندمان 33 تا 35% خواهد بود
- نسبت توان به وزن در مقایسه با دیگر پیل های سوختی کمتر است
- سنگین، حجیم و گران قیمت هستند.
واکنش های حاکم:
از استوکیومتری واکنشها نتیجه میشود که به ازای هر مول O2 دو مول H2 لازم است.
برای واکنش پیوسته و مداوم حتماً بایستی:
- الکترون ها از طریق مدار خارجی منتقل شوند
- یون های + H نیز از طریق الکترولیت خود را به کاتد برسانند. زحمت این کار با اسید دارای یون نام برده، می باشد.
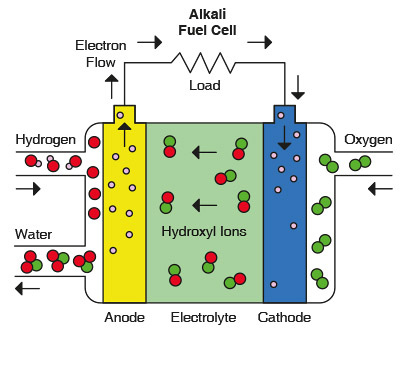
پیل سوختی قلیایی:
پیل های سوختی قلیایی (AFC) جزء اولین فناوری های پیل های سوختی هستند که توسعه یافتند و عمدتا برای تولید انرژی الکتریکی و آب در سفینه های فضایی به کار رفته اند. در این پیل ها، از محلولی از هیدروکسید پتاسیم در آب به عنوان الکترولیت استفاده می شود و می توان ان متفاوت از فلزهای ارزان را به عنوان کاتالیزور در آند و کاتد به کار برد. AFC های دما بالا در دماهام ۱۰۰°C تا C° ۲۵۰ کار می کنند. طراحی های جدید AFC برای کار در دماهای کمتر (حدود۲۳°C تا C°۷۰) هستند.
برخی نکات و ویژگی ها:
- پیل کارامدی هستند
- نرخ واکنش بالایی دارند
- در کاربردهای فضایی راندمان بالای 60% را دارند.
- عیب این نوع پیل ها مسموم شدن سریع آنها در مواجه با مونوکسید کربن میباشد.
- هزینه نسبتا بالایی دارند.
واکنش های حاکم:
در اینجا یون – OH به جای +H به عنوان یون محرک ایفای نقش می کند
در سمت آند یون – OH با هیدروژن واکنش داده و آب و الکترون تولید می کند:
در سمت کاتد نیز اکسیژن با الکترون ها و آب واکنش داده و تولید یون –OH می کند:
برای پیشروی پیوسته واکنش های فوق بایستی یون – OH به طور پیوسته از الکترولیت عبور نماید. مدار خارجی نیز مانند قبل باید برقرار باشد.
همانند الکترولیت اسیدی باز هم به ازای هر اکسیژن دو هیدروژن مورد نیاز می باشد. با دقت به تولید آب در آند نیز میتوان به تفاوتش با اسیدی پی برد!